یک مطالعه جدید نشان می دهد که در بیماری آلزایمر، قطعه ای از پروتئین پیش ساز آمیلوئید (APP-CTF) فرآیندهای سلولی کلیدی را مختل می کند و به طور بالقوه باعث مرگ زودهنگام عصبی می شود. این یافته نشان می دهد که درمان AD باید بر جلوگیری از تجمع APP-CTF تمرکز کند.
APP-CTF ها در ارتباط بین اندامک ها اختلال ایجاد می کنند و تعادل سلولی را مختل می کنند.
آلزایمر (AD) همچنان یک بیماری تخریب کننده عصبی مهم و گسترده است که میلیون ها نفر را در سراسر جهان تحت تاثیر قرار می دهد. در مطالعه ای که اخیراً در سلول توسعهمحققان آزمایشگاه Wim Annaert (VIB-KU Leuven) مکانیسم جدیدی را شناسایی کرده اند که به طور بالقوه مربوط به مراحل اولیه AD است.
آنها نشان دادند که بخشی از پروتئین پیش ساز آمیلوئید (APP)، به نام APP-CTF، ارتباط بین بخش های سلولی حیاتی برای ذخیره کلسیم و دفع زباله را مختل می کند، که ممکن است یک رویداد اولیه قبل از مرگ سلول عصبی باشد. این یافته ها، با پیامدهای بالقوه برای توسعه درمان های جدید AD، نشان می دهد که پیشگیری از تجمع APP-CTF باید برای توسعه درمان های موثرتر در نظر گرفته شود.
بیماری آلزایمر با از دست دادن پیشرونده عملکرد شناختی، اختلال حافظه و تغییرات رفتاری مشخص می شود. یکی از ویژگی های قابل مشاهده در مغز افراد مبتلا به بیماری آلزایمر، تشکیل پلاک های آمیلوئید – توده های پپتیدهای β-آمیلوئید (Aβ) است که محصولات تجزیه پروتئین پیش ساز آمیلوئید (APP) هستند. این قطعات Aβ در اوایل بیماری، حتی قبل از مشاهده زوال شناختی، در نورون ها تجمع می یابند.
با این حال، تحقیقات جدید نشان می دهد که حتی ممکن است رویدادهای زودتر در مغز AD قبل از تشکیل پلاک رخ دهد و پروتئین APP در این مراحل اولیه نقش دارد. مکانیسم پشت این امر تا کنون یک راز باقی مانده است.
در جدیدترین مطالعه خود، آزمایشگاه ویم آنارت در مرکز VIB-KU Leuven برای تحقیقات مغز و بیماری مکانیسمی را شناسایی کرد که توضیح میدهد چگونه APP ممکن است در این مراحل اولیه AD نقش داشته باشد. این یافته ممکن است منجر به جهت گیری جدیدی در رویکردهای تحقیقاتی و درمانی AD شود.
قطع ارتباط سلولی
APP در غشای سلولی سلول های مغز یافت می شود. مغز به طور مداوم در حال تولید مولکول های APP جدید است و در عین حال مولکول های قدیمی را تجزیه و حذف می کند. این فرآیند شامل قیچی آنزیمی است که گاما سکرتاز آخرین موردی است که پپتیدهای Aβ شناخته شده و مورد مطالعه را در AD تولید می کند.
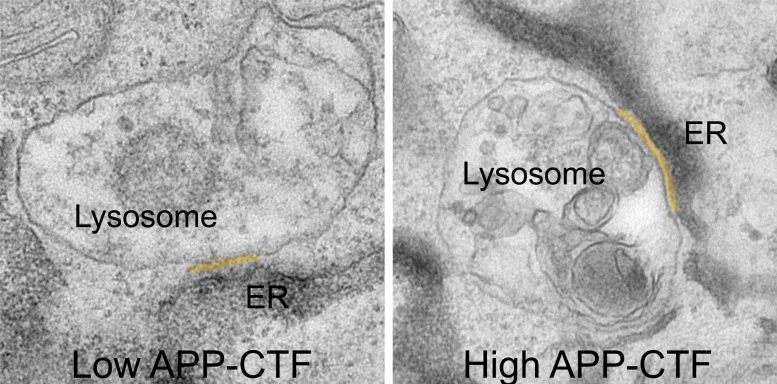
مدتها تصور میشد که مسدود کردن گاما سکرتاز گامی منطقی برای جلوگیری از تولید قطعات سمی Aβ است. با این حال، این منجر به تجمع پیش ساز آنها، قطعات ترمینال APP-C یا APP-CTF می شود. اکنون محققان دریافته اند که این قطعات برای نورون ها نیز سمی هستند. به نظر می رسد که آنها بین شبکه آندوپلاسمی (ER)، محفظه ای که برای سنتز لیپید و ذخیره کلسیم حیاتی است، و لیزوزوم ها، به اصطلاح “سطل زباله” نورون ها که برای تجزیه مواد زائد سلول حیاتی هستند، تجمع می یابند.
دکتر مارین برتو، نویسنده اول این مطالعه توضیح می دهد: «به این ترتیب، APP-CTF ها تعادل ظریف کلسیم در لیزوزوم ها را مختل می کنند. «این اختلال مجموعه ای از وقایع را به وجود می آورد. ER دیگر نمی تواند به طور موثری لیزوزوم ها را با کلسیم بارگذاری کند، و باعث ایجاد کلسترول و کاهش توانایی آنها در تجزیه ضایعات سلولی می شود. این منجر به فروپاشی کل سیستم اندولیزوزوم می شود، مسیری حیاتی برای حفظ نورون های سالم.
مطالعه جدید بیشتر تأیید می کند که APP-CTF ها در نتیجه سرکوب گاما-سکرتاز ممکن است در واقع مقصر اختلال عملکرد اندولیزوزوم باشند همانطور که در مراحل اولیه AD مشاهده می شود.
تغییر پارادایم در درک مراحل اولیه پاتوژنز AD
این تحقیق درک ما را از علل بالقوه بیماری در مراحل اولیه بیماری پس از میلاد بسیار افزایش میدهد. یک نتیجه قابل توجه از این مطالعه این است که این مراحل اولیه ممکن است توسط قطعه دیگری از همان مولکول APP به جای Aβ ایجاد شود. این پیامدهای قابل توجهی برای رویکردهای درمانی فعلی دارد که هدف آنها پاکسازی مغز AD از پلاک های آمیلوئید است، زیرا آنها تمایل دارند اثرات سمی سایر قطعات را نادیده بگیرند. کارآزماییهای دیگر بر روی پروتئینهای تاو یا التهاب عصبی متمرکز شدهاند که نشانههای دیگر پیشرفت AD هستند و رویدادهای بعدی را هدف قرار میدهند. با این حال، مداخله زودهنگام احتمالا کلید توقف یا حتی پیشگیری از AD است.
پروفسور Wim Annaert، نویسنده اصلی این مطالعه توضیح میدهد: «شکست کارآزماییهای بالینی با استفاده از مهارکنندههای گاما سکرتاز را میتوان با این واقعیت توضیح داد که ما فقط روی یک مقصر و در یک مرحله بسیار دیر از بیماری تمرکز کردیم.» “نتایج تحقیقات ما نشان می دهد که تعدیل کننده های گاما سکرتاز، که می توانند به پاکسازی APP-CTF های سمی بدون مسدود کردن کامل آنزیم کمک کنند، ممکن است هدف مناسب تری برای مداخله زودهنگام در AD باشند.” نکته کلیدی ممکن است یافتن تعادل مناسب بین پاکسازی APP-CTF و پیشگیری از پلاک باشد.
با نگاهی به آینده، دانشمندان در حال پیوستن به نیروهای خود با همکاران خود برای توسعه این تعدیل کننده ها بر اساس این بینش های جدید هستند و به بررسی هموستاز سلولی در مراحل اولیه پس از میلاد ادامه خواهند داد.
مرجع: “انباشت قطعات C ترمینال APP باعث اختلال عملکرد اندولیزوزومی با اختلال در تنظیم مکان های تماس دیررس آندوزوم به لیزوزوم-ER می شود” توسط Marine Bretou، Ragna Sannerud، Abril Escamilla-Ayala، Tom Leroy، Céline Vrancx، Acker Zoë P. ، آنیکا پردوک، وندی ورمیر، اینگه وورسترز، سوفی ون کیمولن، میشل ماکسسون، بنجامین پاوی، کیمپ وییردا، ایوا-لیزا اسکلینن و ویم آنارت، 15 آوریل 2024، سلول توسعه.
DOI: 10.1016/j.devcel.2024.03.030
این تحقیق توسط Fondation Recherche Alzheimer – Stichting Alzheimer Onderzoek (STOPALZHEIMER.BE)، انجمن آلزایمر و برنامه FWO تامین مالی شد.